
在治疗脑动脉瘤时,医生可以在血管内放置一类称为血流导向支架的装置,改变血液流量,减少血管破裂的风险。通常在进行相关研究时,研究人员通常会假设支架周围的血流是牛顿流体。然而这种假设可能并不准确,因为支架周围的血流速度远低于正常情况。研究人员借助 COMSOL Multiphysics® 软件将这种假设与一个更真实的非牛顿流体模型进行了对比,测试了将血流模拟为牛顿流体的准确性。
血流导向支架:一种治疗脑动脉瘤的方法
动脉瘤或颅内动脉瘤常发生于充满血液并且像气球一样膨胀出来的动脉血管中,此时血管壁会变得非常薄,如果膨胀出来的部分破裂,就可能导致大出血。医生可以用多种方法治疗这些膨胀凸出物(或动脉瘤囊),其中包括外科手术或血管内治疗方法。
不同类型的血管瘤。图片摘自 G. Mach、C. Sherif、U. Windberger、R. Plasenzotti 和 A. Gruber 在 COMSOL 用户年会 2016 慕尼黑站发表的演示作品。
今天,我们主要讨论的是血管内治疗方案(例如使用血流导向支架),减缓血液流入动脉瘤囊的速度。当血流开始减慢时,将会形成凝血过程,最终使病变区域愈合,有助于保护血管壁,降低大出血的风险。

一种典型的支架。图片由 Lenore Edman 拍摄,在 CC BY 2.0 许可下使用,通过 Flickr Creative Commons 共享。
通常,当研究人员利用数值模拟方法进行研究时,假设血液是粘度恒定的牛顿流体,并以此来模拟颅内动脉瘤和脑动脉中的血流。这个假设的前提是血液的流速和剪切速率非常高,这意味着可以忽略它的剪切变稀特性。
但是对于血流导向支架,这种假设或许并不准确,因为血流导向支架使血流减慢,降低了动脉瘤囊内的血流剪切率,使血液表现出微弱的牛顿流体特征。
这便引出了一个值得思考的问题:血流导向支架附近的血流与血管中的血流有所不同,那么将它模拟为牛顿流体是否准确?为了回答这个问题,奥地利维也纳脑血管研究小组(Cerebrovascular Research Group Vienna)与来自维也纳技术大学(Vienna University of Technology)、Rudolfstiftung 医院、维也纳医科大学(Medical University of Vienna)的研究人员们联手合作,采用 COMSOL Multiphysics 的“CFD 模块”对动脉瘤囊和血管中的血流进行了分析。
借助 CFD 仿真分析动脉瘤囊后方的血流
第一步,研究小组测量了不同剪切速率下的人体血液的粘稠度,并利用这些数据得出了模型参数。他们还特别指出,血液粘稠度取决于剪切速率、红细胞比容(hematocrit,简称 HCT)和温度等多种因素。
接下来,研究小组创建了一个颅内侧壁动脉瘤模型,在模型中,动脉瘤被描绘成了脑内载瘤血管一侧的一个圆形凸起,研究人员在其附近放置了一个用于治疗的复杂血流导向支架,并且从充满血液的血管域内移除了它所占的区域。
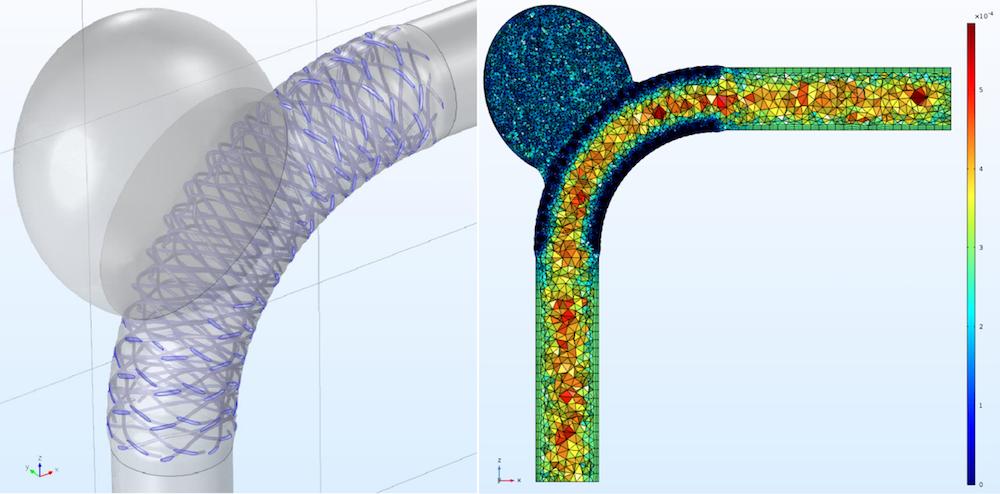
左图:模型几何结构,其中包括载瘤血管、脑动脉瘤和血流导向支架。图片显示了动脉瘤颈平面和支架引起的血管壁扩张。右图:模型网格。图片来源于 G. Mach 等人员,摘自他们在 COMSOL 年会 2016 慕尼黑站发表的演示作品。
现在让我们来仔细观察一下支架,它的渗透率为 55%,与工业样品基本一致,由 16 条金属线编织成网状。真正的支架由更多金属丝构成,横截面也更小,比这个支架模型复杂得多。
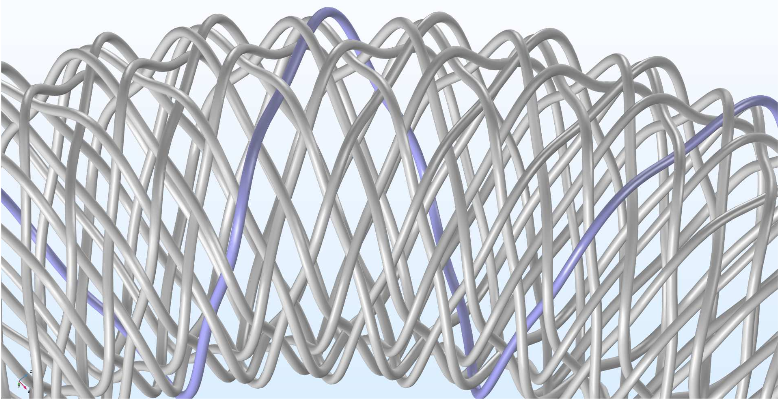
图像中的高亮线突出显示了血流导向支架的编织方式。摘自 G. Mach 等在 COMSOL 用户年会 2016 慕尼黑站发表的演示作品。
基于之前创建的模型和血液粘稠度,研究小组通过 CFD 仿真观察了支架结构中的血流。他们可以看到两个不同模型中流体流动的速度变化情况:
- 牛顿模型具有恒定不变的动力粘度。
- Carreau-Yasuda 模型,最常用于表征人体血液粘稠度的非牛顿模型之一。
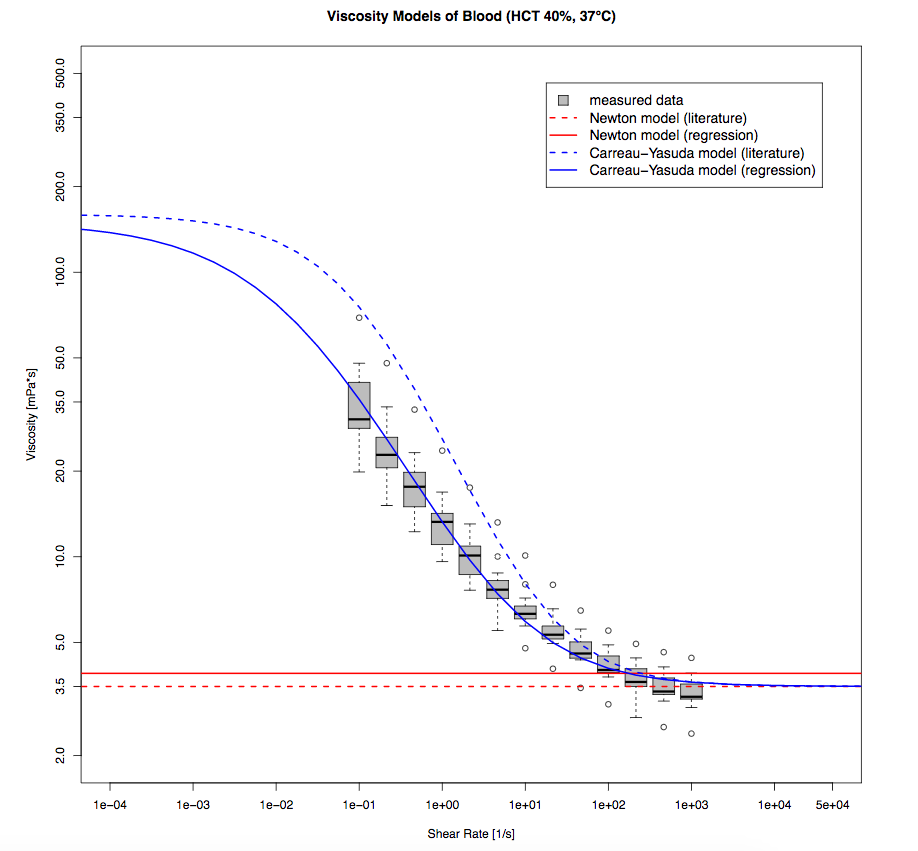
不同模型血液粘度值测量数据的对比。图片摘自 G. Mach 等人员在 COMSOL 用户年会 2016 慕尼黑站发表的演示作品。
确定两种 CFD 模型的准确性
在比较粘度值时我们发现,Carreau-Yasuda 非牛顿模型的与牛顿模型的粘度不同,前者的动态粘稠度值在 3.57 ~7.1 MPa·s 的范围内变化。
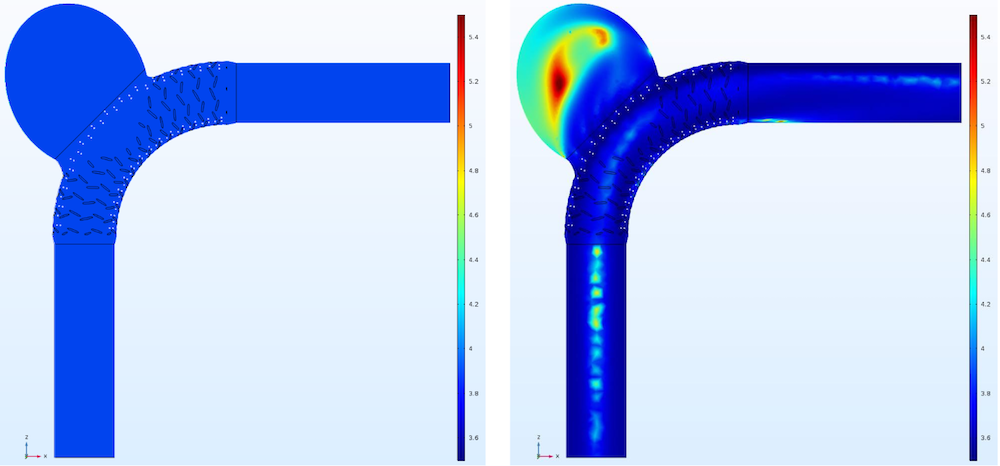
牛顿模型(左图)和 Carreau-Yasuda 模型(右图)中的粘度分布图。图片摘自 G. Mach 等人员在 COMSOL 用户年会 2016 慕尼黑站发表的演示作品。
在这两个模型中,Carreau-Yasuda 模型的剪切速率稍大一些,流向动脉瘤囊的总流量和动脉瘤囊内的平均流速也较高。需要注意的是,上述数值对比均是在收缩期最高的速度分布值出现在入口平面时进行的。
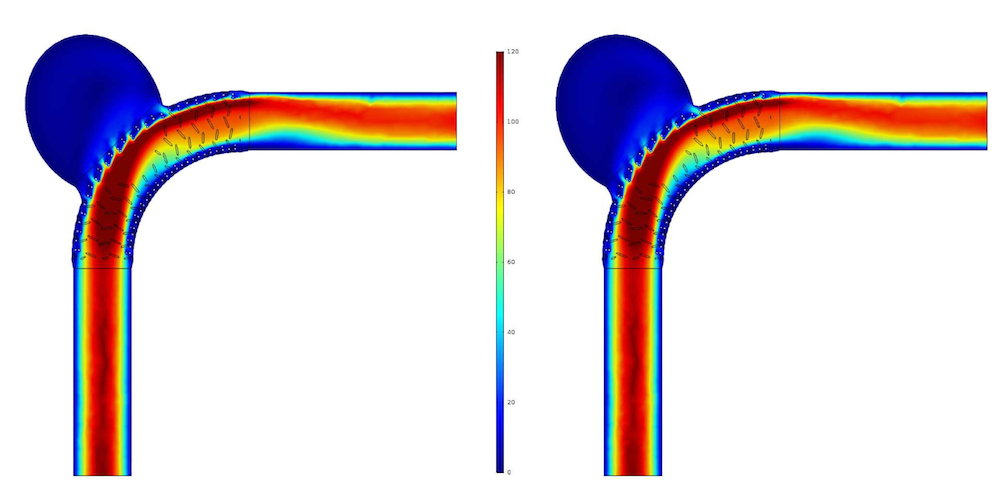
牛顿模型(左图)和 Carreau-Yasuda 模型(右图)中的血流速度分布。图片摘自 G. Mach 等人员在 COMSOL 用户年会 2016 慕尼黑站发表的演示作品。
根据这些数据可以看出,牛顿模型对血流导向支架的影响高估了 4%~6%。虽然流量分布图没有显示这些不同,但可由特征数据推测出来。因此,这就表明,牛顿模型对经过血管内装置血流的分析结果不够精确。
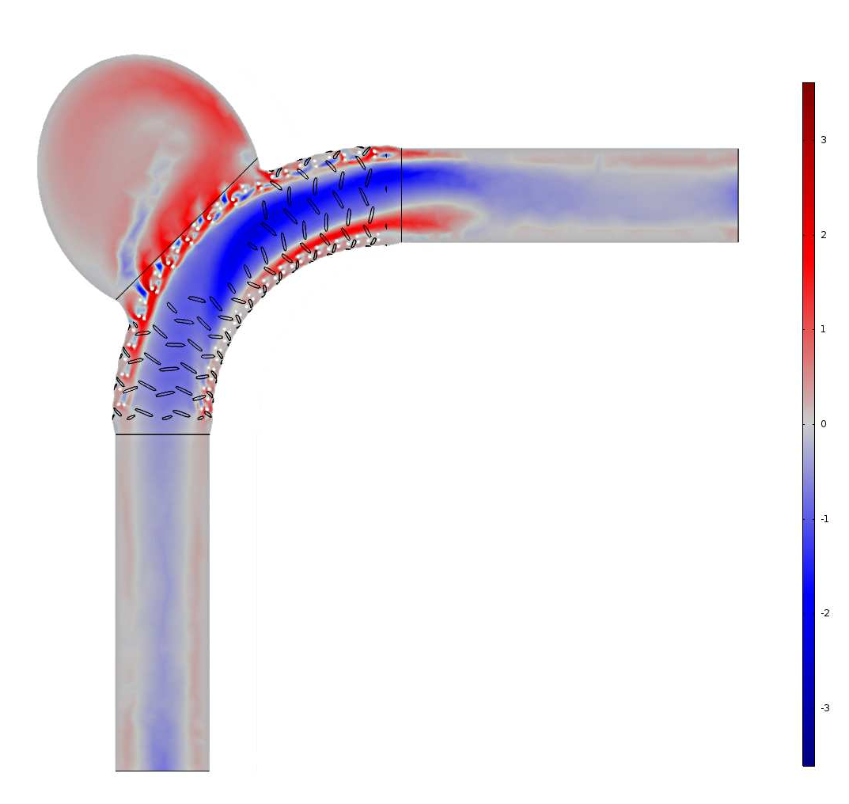
从 Carreau-Yasuda模型的速度分布结果中减掉牛顿模型的结果。图片摘自 G. Mach 等人员在 COMSOL 用户年会 2016 慕尼黑站发表的演示作品。
准确模拟支架周围血流的下一步工作
今天讨论的研究内容为测试牛顿和非牛顿血流模型的准确性提供了坚实的基础。研究小组的下一步计划是在更低的剪切速率下对血液进行更多的测量分析,并针对活的有机体内 收集实际血流导向支架的三维图像,以此不断提高模型的准确性。通过采用新的数据和层析图象,模型的准确性将会有大幅的提升。
学习更多有关 COMSOL Multiphysics® 在医疗领域中的应用
- 阅读发表于 COMSOL 用户年会的论文全文:“A Non-Newtonian Model for Blood Flow behind a Flow Diverting Stent”
- 查看 COMSOL Multiphysics在医疗领域的其他应用:






评论 (0)