
在上一篇博文中,我们介绍了基于侧流分析(LFA)的快速检测的原理。今天这篇文章,我们来看看如何利用这种测试检测新冠肺炎(COVID-19)。另外,我们使用 COMSOL Multiphysics® 模拟了三个模型,用于理解这些简单的、稳固的和先进的微实验室是如何工作的。
新冠肺炎是如何检测的?
当人体感染新型冠状病毒 SARS-CoV-2 后,免疫系统会迅速形成抗体。树突状细胞可能呈现病毒抗原,以便被 T 细胞识别。T 细胞可以激活 B 细胞,分泌靶向抗原的抗体(参考文献1)。首先形成的是 IgM 抗体。这些抗体一旦靠近就会附着在病毒颗粒的抗原表面。例如,就冠状病毒而言,这些抗原可以是病毒表面的刺突蛋白(S 抗原)。一旦附着在抗原上,抗体就会阻断病毒的刺突蛋白,阻止它们附着并感染人类细胞。这样就可以中和病毒,因为它不能在受感染的细胞外复制。有许多不同的抗体可以靶向不同的抗原。需要注意的是,人体还有其他对抗感染的机制。此外,识别病毒的T细胞也可能直靶向受感染的细胞。它们可以指示细胞进行自我毁灭,或者杀死被感染的细胞,从而中和病毒。
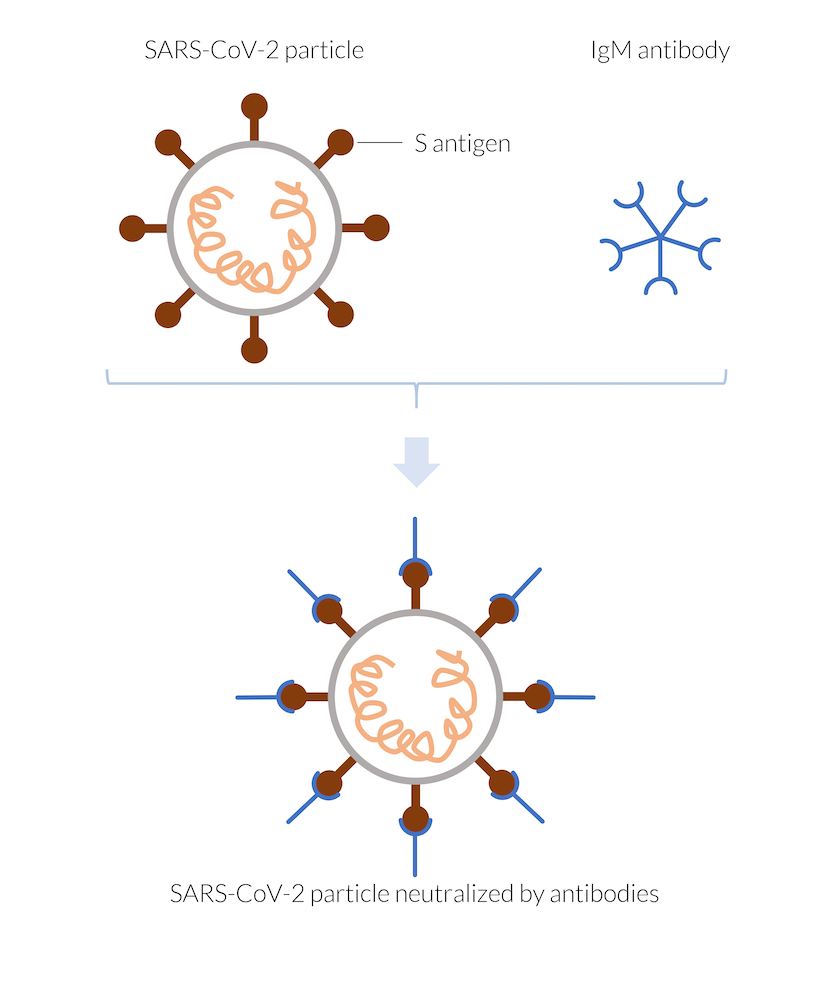
由免疫系统制造的 IgM 抗体附着在例如新型冠状病毒颗粒的刺突抗原(S 抗原)上,从而中和病毒颗粒。被中和的病毒颗粒不能进入人体细胞,因此不能进行自我复制,最终被破坏。
IgM 抗体五个一组形成小颗粒(或大分子)在人体内巡视,附着在他们遇到的每一个病毒颗粒上。在感染的后期,免疫系统还会形成其他抗体,例如 IgG,它们会自动巡视身体,并附着在能看到的每一个病毒颗粒上。IgG 抗体需要更长的时间才能被身体制造出来,但是它们持续时间也更长,并且只要存在 IgG 抗体就可以产生免疫力。
新冠肺炎的一些LFA快速检测是基于 IgM 和IgG 抗体的检测。这些就是本篇博文建立的模型所研究的测试。
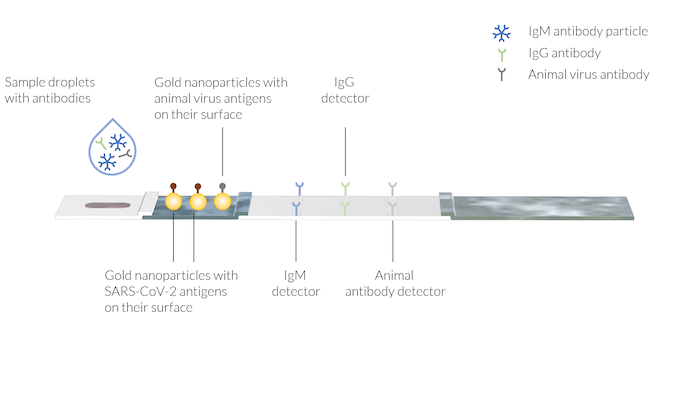
样本中含有因感染新冠肺炎而产生的人类抗体 IgM 和 IgG。动物抗体也与缓冲溶液一起被加入样本液体中。在三个不同区域的测试线上固定了抗体检测试剂。请注意,图中测试线尚不可见。
在检测时,可以将患者的血液(或唾液)施加到样品孔上,然后在样品孔中滴入几滴缓冲液,来应用缓冲液。
样品在毛细管力的作用下被输送到连接板上。在这里,IgM 和 IgG 抗体与标记物形成络合物。络合标记物可能是一个表面上具有新型冠状病毒抗原的纳米金颗粒。之后形成两种不同的络合物:
- IgM 的络合物(IgM-C)
- IgG 的络合物(IgG-C)
这些络合物在样品溶液中溶解。
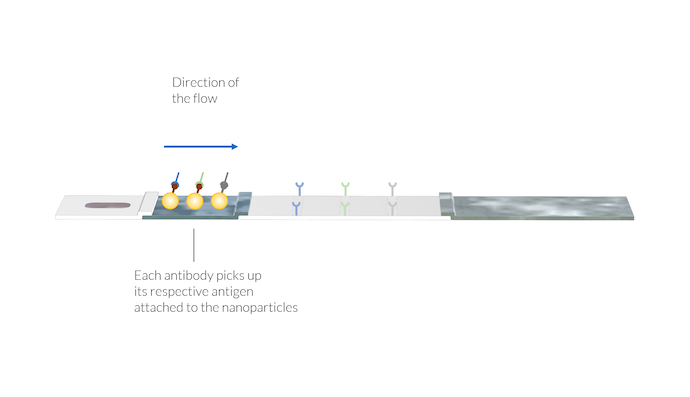
IgM 和 IgG 抗体通过附着在颗粒表面的 SARS-CoV-2 抗原被吸附到纳米金颗粒(络合物标记)上。此外,动物病毒抗体会吸附各自的纳米金颗粒。抗体和颗粒的络合物溶解在流动液中,并与样品溶液一起被运送到膜上。请注意,此时测试线仍不可见。
此外,可能还有第二个与来自动物病毒的抗原结合的纳米金颗粒。这些络合标记物可以附着到缓冲溶液提供的参考动物抗体上。动物抗体和络合标记物(AA-C)的络合物也溶解在样品液体中,并用于随后的对照线检测。
样品随后在毛细管作用力下被输送到膜上。在第一条测试线中, IgM 检测试剂在膜的制造过程中被固定在膜表面。这些 IgM 检测试剂会捕获 IgM-C 络合物,并使这些络合物固定在该测试线的区。纳米金颗粒发生聚集并将测试线染成红色,显示测试线上络合物的存在。
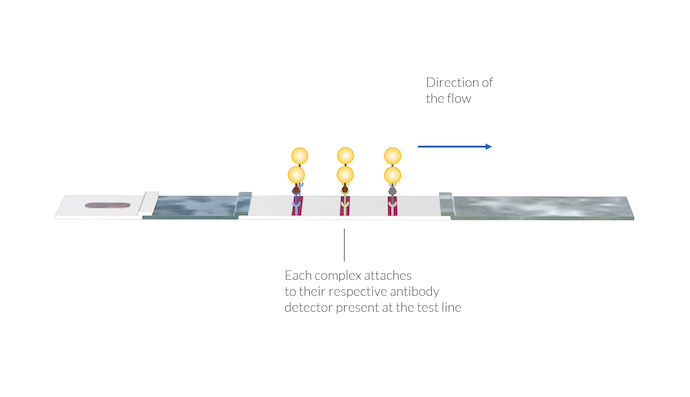
抗体-抗原-纳米金颗粒络合物附着在各自的抗体检测试剂上,抗体检测试剂位于测试线的位置。一旦络合物被固定在测试线表面,由于表面上存在纳米金颗粒,测试线颜色就会出现。
同样,在第二条测试线上,IgG-C 络合物与固定的IgG检测试剂发生反应。一旦 IgG-C 络合物附着到 IgG 检测试剂上,由于纳米金颗粒的存在,第二条测试线的颜色会变为红色。
然后,当对照测试线遇到氨基酸-碳络合物(AA-C complex)时,通过附着在对照测试线区域膜上的动物抗体检测试剂,以类似的方式进行反应。对照测试线的颜色显示样本已经通过膜区,包括IgM和IgG检测区。如果对照测试线没有着色,那么该测试应该被视为无效,因为样本没有以预期的方式通过膜。
液体溶液继续流向吸收板(芯板)。吸收板的孔体积决定了可以流过测试条的样品体积。一旦吸收路径满了,测试条中的液体流动就停止了。重新开始流动的唯一可能是蒸发吸收板中的一些样品液。
使用 COMSOL Multiphysics® 建立的快速检测的3种模型
本文作者使用 COMSOL 建立了 3 个模型用于研究 LFA 快速检测。
首先,使用一个完整的 3D 模型,以确定样品液体是否均匀分布在测试条中,并研究采样孔位置的影响。此外,可以使用 3D 模型研究吸收板的吸收能力,以得到穿过测试条的流量。
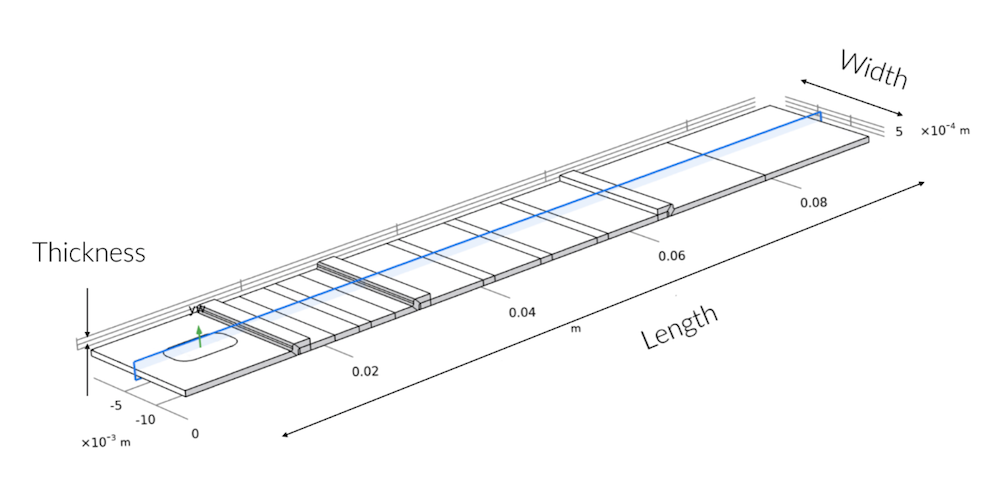
蓝色阴影横截面显示了 3D 几何图形中的 2D 建模平面。沿宽度方向的对称偏差仅出现在样品板中,其中,样品板中的样品孔没有布满测试条的整个宽度。
很快我们发现,一旦样品溶液通过样品板,样品液流动会迅速形成一个平坦的速度曲线。这意味着它沿着测试条的宽度均匀流动,也就意味着 2D 模型足以理解快速检测装置的挑战和功能,只要样品板能够均匀地分配流体。因此,我们使用 2D 模型来研究测试条中的传输和反应。2D 模型允许我们沿着测试条的长度和厚度使用更高分辨率的网格。
这些模型结合使用了 COMSOL Multiphysics 中用于多孔介质流动的理查兹方程 接口和稀物质传递 接口(参考文献2)。形成 IgM-C、IgG-C 和抗 AA-C 络合物的反应由 化学 接口定义。此外,测试线上的表面反应也由化学 接口定义。对于 2D 模型,我们使用了两种不同的方法:
- 假设络合物在测试线上的吸附仅发生在膜表面
- 假设检测中的吸附过程发生在测试线位置下方的整个膜厚度上
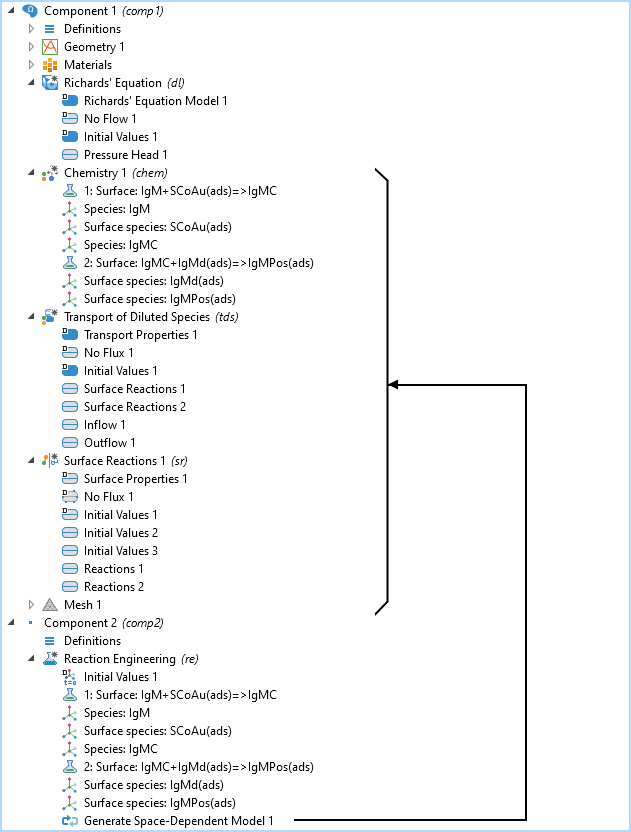
含 2D 模型组件和 理查德方程模型的模型树,化学、稀物质传递,表面反应接口,和 反应工程接口。生成空间相关模型节点将传输和化学接口添加到已经存在的 2D 模型组件的理查德方程接口。
IgM 反应路径的模型树如上图所示。化学,稀物质传递 和表面反应 接口都均是由反应工程 接口建立的,其中使用了生成空间相关模型 功能。
连接板中的化学反应定义如下:
- 连接板中纳米金颗粒上的 IgM 和 SARS Co-2 抗原之间的反应定义为:
IgM +SCoAu(ads) => IgMC
-
- 术语(ads)用于表示抗原和纳米粒子被吸附在连接板的孔结构中,并被 IgM 吸附以形成 IgMC 络合物,IgMC 络合物溶解在溶液中。
- 可以得到IgG抗体的类似反应: IgG + SCoAu(ads) => IgGC
- 动物抗体与动物抗原在纳米金颗粒上的反应可定义为: AA + AAu(ads) => AAC
因此,IgMC、IgC 和 AAC 是共轭抗体络合物。
测试线中的反应如下:
- 在第一条测试线上: IgMC + IgMd(ads) => IgMPos(ads)
- 上式说明了IgMC络合物与吸附的IgMd检测蛋白反应,形成吸附的IgMPos表面络合物。IgMPo络合物可以使第一条测试线变色。
- 类似于上面的4条,在第二个测试线中,有: IgGC + IgGd(ads) => IgGPos(ads)
- 吸附的 IgPos 络合物使第二条测试线呈现红色。
- 在第三个测试线中,有: AAC + AAd(ads) => AAPos(ads)
- 吸附的物质 AAPos 使参考测试线呈现红色。
模型结果
下图显示了测试条在四个不同时间的流动曲线。我们可以看到,最初,样本前端沿着测试条的中部进一步延伸到测试条中,形成一个略微呈抛物线的曲线。抛物线曲线是由于样品孔处于测试条的中间位置。然而,5 秒钟后,当样品溶液流动已经达到连接板的三分之一时,流动曲线是平坦的(见上一篇博文中的最后一个图)。
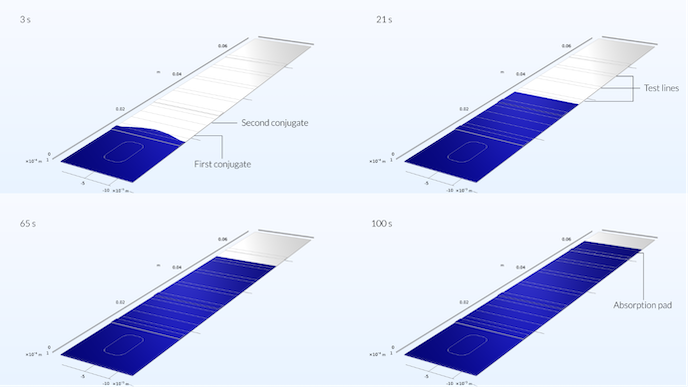
样本在 3 秒钟后已经到达第一个结合区域。在这里,我们仍然可以注意到样品孔的位置对样品液延伸的影响,因为它不是平坦的,而是在中间显示出最大的延伸。21 秒后,当样本液到达第一个测试线区域时,速度曲线是一条直线。65 秒后,样本液流到达参考测试线,100 秒后到达吸收板。
由上图我们还可以看到,样品液沿着垂直于通道中间测试条的平面是对称的。这意味着我们只需要求解一半的装置就可以解决这个问题。尽管这是一个对称问题,但对整个装置进行建模是一个很好的方法,可以检查网格是否足够密集,以得出关于流动曲线的任何结论。流动曲线是对称的表明这里的网格可能足够密集。
下面,我们来看看第一条测试线位置处样品的流速图,见下图。我们可以看到,在样品被施加到样品孔后大约 20 秒开始流动,流动在 275 秒左右停止。这与吸收板充满液体样品的时间一致。
同样有趣的是,流速随着时间的推移几乎呈指数衰减。这是因为驱动流动的毛细管力仅作用在样品溶液与空气相遇的孔隙表面(液体前沿的三相边界区域)。这意味着毛细管力是恒定的,只要有自由孔隙体积,都可以用样品溶液填充。然而,随着样品溶液体进一步进入测试条,流动阻力增加。与流动样品液体接触的孔壁面积随时间增加,因此孔壁和流动溶液之间的摩擦面积也会增加。
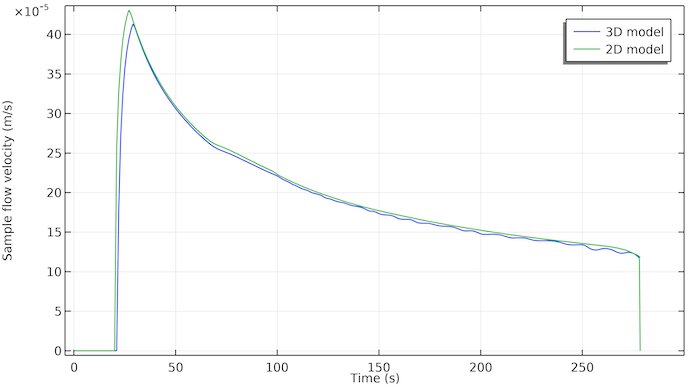
3D 模型(蓝色)和 2D 模型(绿色)第一条测试线位置处的样品流速。这两条曲线非常吻合。3D 模型显示大约 2 秒钟的延迟,这可能是因为样品最初必须沿着宽度流动。在 2D 模型中,样品立即沿宽度均匀分布。
下图显示了不同时步下 IgMC 络合物的浓度。我们可以看到,IgMC 络合物随着流体流动,直到到达第一条测试线的区域。在这里,它与 IgM 检测物质反应后被消耗,形成有色检测线。IgMC 浓度场显示,样品溶液到达测试线后,形成浓度边界层。随着时间的推移,测试线后的浓度耗尽流体继续流动,但测试线周围区域几乎达到稳定状态。然而,一旦流动停止,当吸收板被样品液充满饱和时,则在测试线以下形成更厚的遍及整个膜的耗尽区。以类似的方式,连接线下方的区域也被 IgMC 络合物充满。
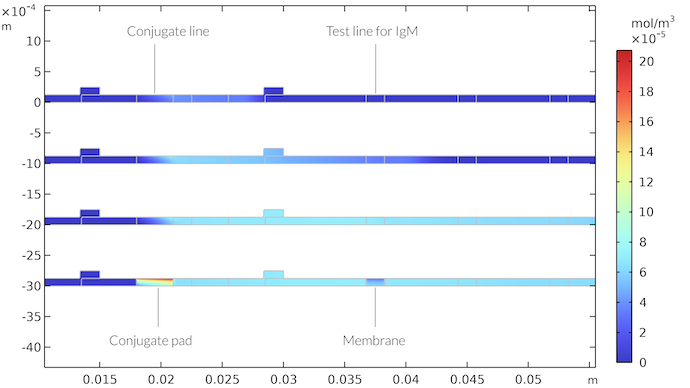
连接板和膜中IgMC的浓度场是时间的函数。时间分别为 21 秒(上)、65 秒、260 秒和 410 秒(下)之后。410 秒后,测试条中不再有任何流体。我们在连接板中得到一个高 IgMC 浓度的区域,在 IgM 测试线以下得到一个低 IgMC 浓度的区域。
如果在测试线的表面绘制检测物质的粒子浓度图,流量的影响是明显的。当流量到达相应的测试线时,粒子浓度开始增加。随着 IgMC 被吸附在测试线区域并形成检测 IgMPos 物质,浓度几乎是线性增长的。线性增长意味着恒定的吸附速率。当流动停止时,由于吸收板饱和,IgMPos 继续以大致相同的速率形成。这意味着,在这种情况下,IgMPos 的形成由吸附动力学决定,即由 IgMC 中的纳米金粒子对吸附位点的吸附速率决定。如果它是由质量运输控制的,我们会看到曲线斜率的变化,当流动停止时,增长会减慢。如果改变吸附动力学的速率常数,曲线斜率当然也会改变。测试线的可见度大约从每平方毫米 1·108 个粒子开始。
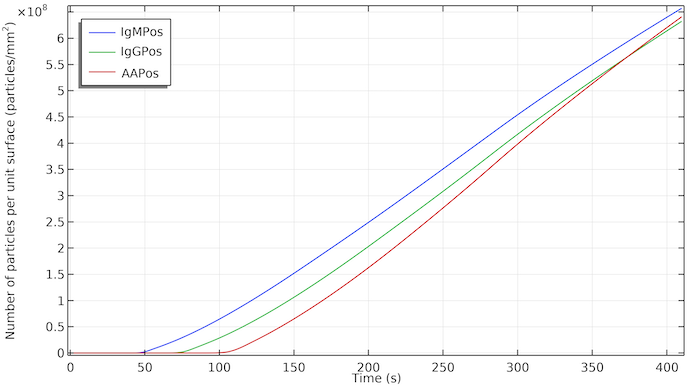
在各自的测试线表面的 IgMPos, IgGPos,和 AAPos 浓度是时间的函数。IgMPos 和 IgGPos 竞争同一个络合物标记,因此 AAPos 生长稍快。
因此,如果三条测试线的动力学相似,我们会看到第一、第二和第三条(对照)测试线的显示延迟。此外,每条测试线将在面向流动的边缘开始着色,测试线的尾部会稍晚显示。
如果我们将动力学调整为均相流动,均相模型显示出类似的结果。然而,此时的传输要快得多,因为反应位点遍布在连接板的整个厚度,测试线则横跨膜的厚度。反应物不必被运输到测试条的表面。这是一个更复杂的过程,其中动力学和质量传输都限制了测试线的显示。下图显示了对应于上述非均相流动的 IgMC 浓度。
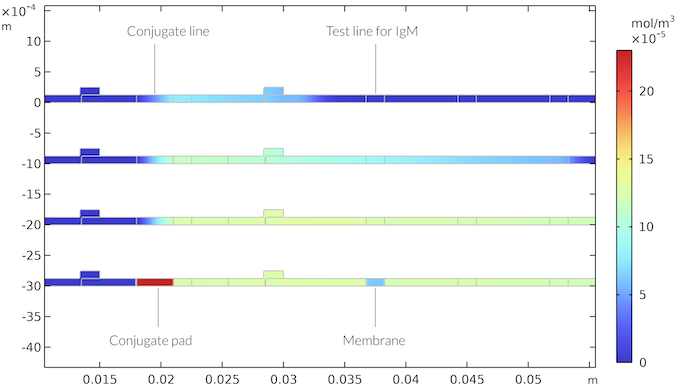
当共轭区包含整个厚度的共轭标记,并且测试线存在于整个膜的厚度时,IgMC 的浓度。其结果与非均相情况类似。
下图揭示了测试线的真实情况。我们可以看到,它在流动方向上有一个小的倾斜,就开始几乎均匀地显现。当流动停止时,测试线两个边缘显出的颜色饱和度更高,因为会有更多的抗体-缀合物络合物通过扩散运输到这些边缘。
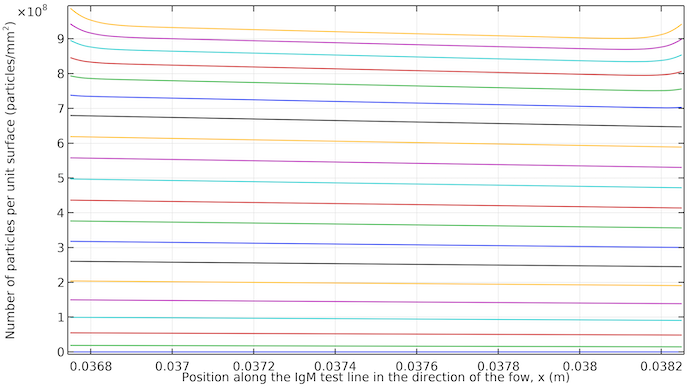
在 IgM 测试线上,每单位表面积的 IgM 络合物浓度厚度超过 10μm。曲线从 20 秒到 400s,增量为 20s。曲线从底部的 20s(低饱和度)开始,到顶部的 400s(高饱和度)结束。大约 260s 后,时步之间的曲线更接近,因为扩散是将抗体-络合物标记络合物运输到测试线区域的唯一方式,从而减慢了过程。
真实的情况可能介于同质和异质模型之间。我们可以认为,获得沿其宽度均匀着色的测试线的好方法是使检测体积接近测试条的表面。这样,传输可以在 x 和 y 方向发生,同时我们得到一个相对较大的反应区(见下图)。对于测试线来说,将反应区扩展到膜的整个厚度对测试并没有帮助,因为膜是不透明的。然而,将连接板的反应区分布在整个厚度上是有利的,因为这将使络合物标记和抗体之间的反应最大化。这样,络合物标记将尽可能多地吸附抗体。
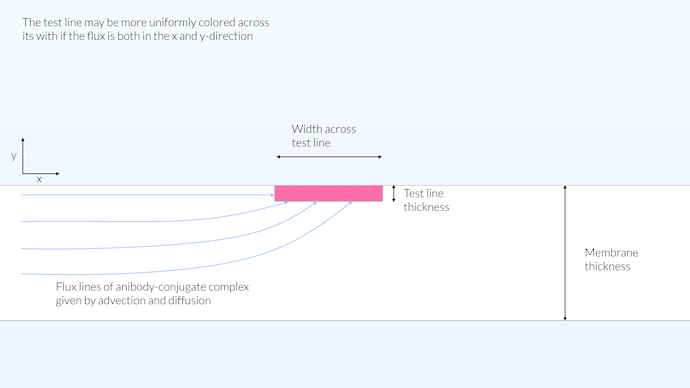
在这种配置中,测试线的反应区不限于表面,也没有分布在膜的整个厚度,其厚度被限制在 15μm。膜不透明,并且几乎不透明,可见深度约为 10μm。有限的测试线厚度允许在测试线的整个宽度上传输,从而在膜的整个宽度上产生相对均匀的颜色饱和度。
结束语
样品在测试条上流动的间隔由吸收板的尺寸决定,吸收板的尺寸也决定了样品的尺寸。更有趣的是,该模型预测了样品在测试条上流动时流速的指数衰减,这对于该领域的科学家来说也是众所周知的,但可能并不完全明显。2D 模拟显示,测试条中的质量传输似乎很慢,在非均相流动情况下,速率决定了测试。流动似乎可以快速地将样品分布在测试条上。然而,吸附反应是如此缓慢,以至于在非均相情况下,质量传递仍然限制了抗体-抗原-纳米粒子复合物向测试线处的吸附表面扩散。在均相流动的情况下,吸附动力学的限制更大。然而,这当然与我们使用的输入数据有关。
为这篇博文中建立的模型仅是一个化学原理。如果要将它们用于测试条的实际开发,必须在获得化学和多孔材料的特性的输入数据上做更多的努力。然而,这些模型包含了重要的物理现象:相对详细的传输和反应描述。
模型改进的可能性:
- 考虑沿膜各处的吸附-解吸。文中我们假设所有物种自由传输,直到它们在测试线上被永久吸附。
- 建立更精确的两相流模型。我们使用了一个简单的多孔介质两相流模型。也可以使用基于相位场的更精确的模型。
- 使用科学文献中公布的特定测试的输入数据。我们对测试条组件中的所有板使用了相同的孔隙率和润湿特性。浓度和吸附动力学使用了产生合理结果的输入数据。然而,为了使用真实的浓度和动力学数据,应该进行文献检索。然而,这对于不同的新冠肺炎检测是不同的,因为每个制造商都有自己的样品制备和检测程序。这篇博文的目的仅仅是展示可能的建模方法,而不是发表科学论文。
- 网格收敛分析。这将显示您在模拟结果中可以预期的准确性。这已经部分完成,我们知道模型给出的数值误差相对较小。但是如果需要严格的精度,就不属于这篇博文的讨论范围了。
参考文献
- L. Gutierrez, J. Beckford, and H. Alachkar, “Deciphering the TCR Repertoire to Solve the COVID-19 Mystery”, Trends in Pharmacological Sciences, vol. 41, no. 8, pp. 518–530, 2020, (https://www.cell.com/trends/pharmacological-sciences/fulltext/S0165-6147(20)30130-9),
- D. Rath and B. Toley, “Modelling-Guided Design of Paper Microfluidic Networks – A Case Study of Sequential Fluid Delivery”, ChemRxiv, 2020, https://doi.org/10.26434/chemrxiv.12696545.v1.
下载模型
您是不是也想尝试模拟对 COVID-19 的快速检测?单击下面的按钮访问案例模型文件,自己动手模拟:



评论 (0)